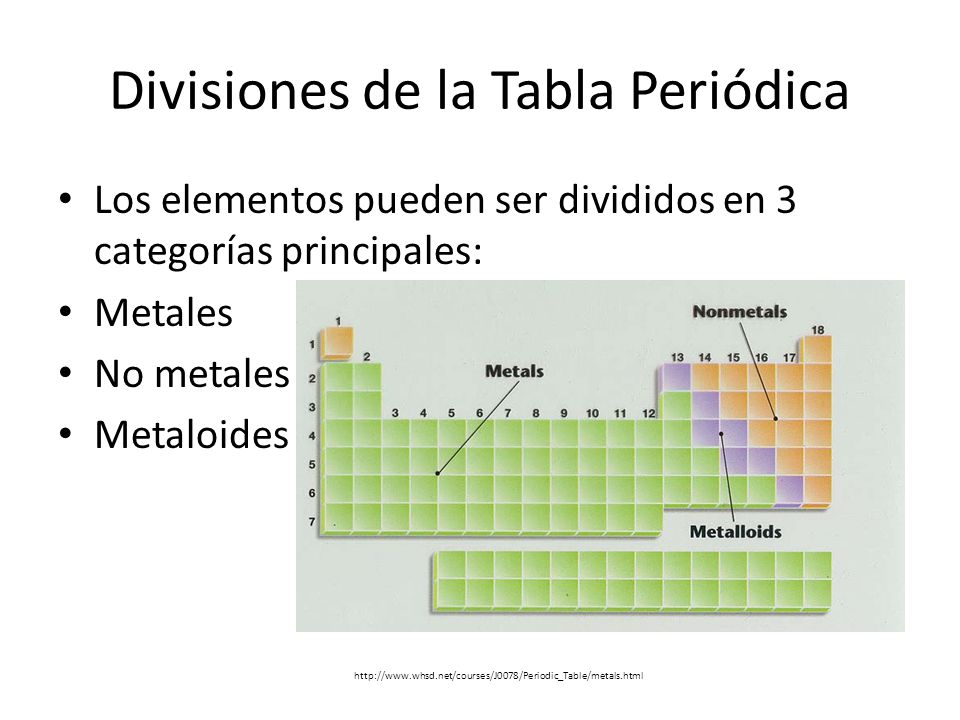
LOS ENLACES QUÍMICOS.
Es la fuerza de atracción entre dos o más átomos que los mantiene ''unidos''.
Los átomos se unen para formar
compuestos que les da estabilidad química. La estabilidad química se
adquiere cuando el átomo adquiere 8 electrones en el último nivel de
energía y esto se llama la regla del octeto. Estas se cumplen ganando,
perdiendo o compartiendo electrones, o se adquiere a configuración
electrónica de un gas noble.
Enlace iónico: Está formado por iones positivos y negativos.
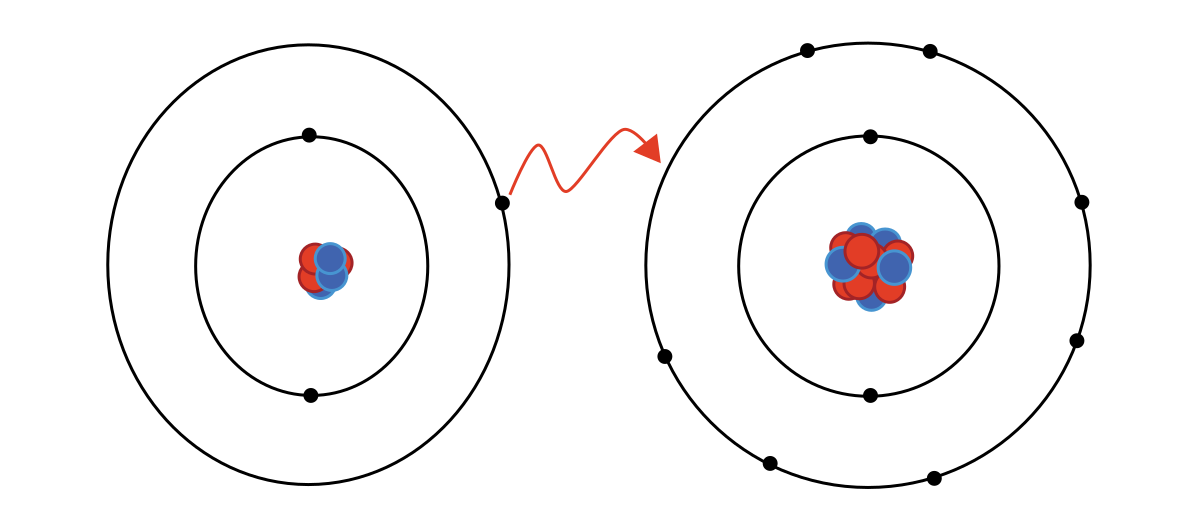
Ión: Es un átomo o una molécula con carga electrica positiva o negativa.
Enlace covalente: Se forma cuando dos o más átomos comparten electrones.